NOTA DEL EDITOR: La abeja no es una especie que atendamos por el enfoque de nuestro trabajo informativo en mamíferos y aves de producción. Consideramos buena idea replantearnos y abrir nuestra plataforma para comunicaciones, como la presente, que plantean soluciones y respuestas a los retos que implican la disminución de las poblaciones apícolas. Debemos ser conscientes que, sin importar nuestra actividad, su presencia y sus funciones en la naturaleza nos benefician a todos y su ausencia nos impactará a todos. El conocimiento es lo primero que nos permitirá entender la situación, exponerla a más personas y actuar en consecuencia para preservarlas.
Loeza-Concha Henry 3 , Domínguez-Rebolledo Álvaro 2 , Vivas-Rodríguez Jorge 2 ,
Ramón-Ugalde Julio* 1 , Castellanos-Zacarias Carlos 1 .
1 Instituto Tecnológico de Conkal, División de Estudios de Posgrado e Investigación. Conkal, Yucatán, México.
2 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Mocochá, Yucatán, México.
3 Colegio de Postgraduados, Campus Campeche. Carretera Haltunchén-Edzná.
Km 17.5, C.P. 24450; Sihochac, Champotón, Campeche, México.
*Autor de correspondencia: Ramón-Ugalde Julio, e-mail: julio.ru@conkal.tecnm.mx

La población mundial de abejas (Apis Mellifera) se encuentra amenazada, debido
a una disminución que resulta alarmante debido. a múltiples factores, como el
cambio climático, la contaminación, los pesticidas, enfermedades y parásitos,
entre otros. En México, se reportan pérdidas de 0.2 millones de colmenas,
atribuible a factores bióticos y naturales (SAGARPA, 2010).
La abeja Apis mellifera es la principal especie polinizadora para aumentar la productividad de los
cultivos, además desempeña una importante función en el mantenimiento de la
biodiversidad. Ante esta problemática, se están empezando a desarrollar nuevas
técnicas reproductivas que permitan poder preservar las abejas. Entre estas
técnicas, se encuentran la congelación de semen de zánganos provenientes de
colmenas sobresalientes, que podrán ser criopreservadas en Bancos de
Germoplasma y ser utilizadas posteriormente, junto con la inseminación
instrumental en programas de conservación o mejoramiento genético. Sin
embargo, la principal dificultad para crear un Banco de Germoplasma radica en
conocer en profundidad la reproducción de la especie o raza en cuestión, puesto
que las técnicas de reproducción asistida y los protocolos de congelación de
gametos varían mucho de una especie a otra. En la congelación del semen de
zánganos, se presentan bajos porcentajes de criosuperviviencia de los
espermatozoides (42.6%) afectando negativamente en la producción de crías de
reinas inseminadas instrumentalmente al obtener tasas bajas de fertilidad (47%),
con respecto al porcentaje con semen fresco que se encuentra entre un 95- 99%.
Esto es debido a factores como cambios en la temperatura del medio de
congelación, así como la osmolaridad y toxicidad de los crioprotectores
empleados y la formación de cristales de hielo intra y extra celulares, son sólo
algunos de los principales factores responsables de la alteración de la estructura y
funcionalidad de la membrana espermática observada en los espermatozoides
criopreservados.
Para minimizar los daños que se producen durante y después de
la criopreservación en los espermatozoides, se han estudiado diversas soluciones
crioprotectoras como el glicerol, dimetilsulfóxido, etilenglicol y la dimetilformamida,
los cuales previenen la formación de cristales de hielo y protegen a los
espermatozoides. Entre los crioprotectores más utilizados en la congelación de
semen de zángano se encuentran el Dimetilsulfóxido (DMSO) y el Glicerol.
Asimismo, se han evaluado infinidad de componentes que se le añaden al
diluyente de congelación, entre ellos la leche descremada de vaca, glicocola,
glicerina, agua de coco, lecitina de soya y la yema de huevo. La finalidad de estos
componentes es la de preservar las características funcionales de las células
espermáticas, mantener el nivel de fertilidad adecuado y protegerlas de las
lesiones provocadas por el choque térmico. Entre estos componentes, la yema de
huevo es uno de los más utilizados en la mayoría de los diluyentes de
criopreservación de semen en casi todas las especies, ya que ejerce un efecto
protector sobre las las membranas de los espermatozoides sometidos a procesos
de criopreservación. Este efecto de protección se debe al aporte de lipoproteínas
de baja densidad (LBD) compuestas por triglicéridos, fosfolípidos y colesterol. Las
LBD previenen la formación de cristales de hielo y protege la integridad de la
membrana plasmática del choque frío. Asimismo, se ha documentado en
diferentes estudios que, la eliminación de las lipoproteínas de alta densidad
(LAD), mejora la calidad del semen, antes y después de su congelación. Debido a
esto, se ha recurrido a la centrifugación de la yema de huevo con la finalidad de
eliminar algunos de sus componentes y conservar principalmente las LBD, las
cuales han permitido mejorar la congelabilidad del semen en varias especies. Sin
embargo, se desconoce el efecto que podría tener el tipo de yema de huevo con
alguno de los dos crioprotectores antes mencionados sobre la criopreservación del semen de zángano Apis mellifera.
Por lo que el objetivo de este reporte es
informar y poner al alcance de los productores tecnificados y técnicos la
factibilidad de utilizar la yema de huevo entera y centrifugada y sus interacciones
con dos tipos de crioprotectores (Dimetil sulfóxido y Glicerol), sobre la
criopreservación del semen de zángano.
Localización y características del área de estudio. La colecta de semen de
realizó en el Instituto Nacional de Investigación Forestal, Agrícola y Pesquera
(INIFAP), ubicado en el Municipio de Mocochá, Yucatán. Las muestras de semen
se evaluaron en el laboratorio de Reproducción asistida del INIFAP campus
Mococha.
Captura y manipulación de los zánganos. La captura de los zánganos se
realizó mediante rejillas excluidoras, las cuales fueron colocadas frente de la
piquera para evitar el ingreso de los zánganos a la colmena y así facilitar su
captura. Estas rejillas se colocaron aproximadamente antes del mediodía, debido
a que se aseguraba la salida de los zánganos para sus vuelos de rastreo, por lo
que la captura se realizó a las 17:00 horas del mismo día asegurando el regreso
de los mismos. La finalidad de esta técnica es obtener individuos adultos de
aproximadamente de 16 días de vida (zángano maduro). Una vez capturados los
zánganos, se colocaban en jaulas transportadoras de 15x15x5 cm; las cuales se
llenaban a un 35 % de su capacidad, que los zánganos pudieran moverse.
Posteriormente los zánganos fueron resguardados en colmenas huérfanas, con la
finalidad de mantenerlos alimentados durante toda la noche. Al día siguiente, los
zánganos fueron liberados en jaulas de vuelo de 40×40 cm, durante diez minutos,
para alentar la defecación y con ello disminuir la contaminación de las muestras,
así como para asegurar el llenado de sus sacos aéreos para obtener una mejor
eversión del endófalo (Taylor et al., 2009) .
Colecta de semen. Se utilizó la técnica descrita por Laidlaw (1977), que implica
forzar de manera manual la eversión parcial y total del endófalo, ejerciendo
presión en el tórax y abdomen. Una vez que se detectó el semen en el endófalo, se procedió a su colecta mediante la liberación de una gota de solución salina sobre el semen expuesto y con la ayuda de una jeringa Harbo Schley (ref. 104), y una lupa estereoscópica modelo SMZ zoom Schley (ref. 2.00) se extrajo el semen. La obtención del semen en todos los zánganos, se realizó hasta llenar un
tubo capilar con capacidad de 100 µL, para posteriormente ser criopreservado.

Crioprotectores. Se utilizaron dos crioprotectores, el Dimetil sulfóxido (DMSO) y
Glicerol a una concentración de 25% de cada uno.
Diluyentes. Las 4 diluciones se prepararon utilizando el método descrito por
Harbo (1983) y Stucky et al., 2008, realizando pequeñas modificaciones. Se utilizó
25% de DMSO o Glicerol, 25% de YHE o YHC, 50 % de solución Buffer (pH 7.2) y
0.05g de estreptomicina.
Preparación de las muestras. Las muestras de semen fueron extraídas del tubo
capilar, y diluidas con su respectivo tratamiento a una concentración 3:2.
Posteriormente, se dejó una alícuota de semen diluido (20 µL), para su evaluación
en fresco y el resto se utilizó para para su congelación.
Evaluación de la calidad seminal en fresco y descongelado. Las variables que
se evaluaron en el semen fresco fueron: La motilidad, viabilidad, concentración y
endósmosis. A la descongelación, las variables evaluadas fueron las mismas que
en fresco, a excepción de la concentración espermática que no sé evaluó.
Concentración espermática. Se estimó mediante la técnica descrita por la World
Health Organization (2010). Mezclando 2.5 μL de semen puro en 497.5 μL de
agua destilada. El número de espermatozoides se observó con una cámara de
recuento celular de Buker, y con un microscopio de contraste de fases UOB
UB203i a 400x.
Motilidad Espermática. Se depositaron 5 µL de semen fresco en un porta objeto
en una placa térmica a 37ºC. Se estimó subjetivamente a través de observación
visual, examinando al menos 5 campos de cada muestra en un microscopio óptico
MO-a 400x a 40x. La valoración se estimó mediante la escala descrita por Locke y Peng (1993), donde: 4 indica más de un 50% de espermatozoides presentando movimiento circular y movimiento progresivo, 3, indica presencia de movimiento circular y progresivo, y más del 50% con movimiento vibratorio; 2, indica más del 50% con movimiento vibratorio; 1, indica menos del 50% con movimiento
vibratorio y 0, sin movimiento.
Viabilidad espermática. Se evaluó de acuerdo a la técnica descrita por Collins y
Donoghue, (1999), con las tinciones de fluorescencia yoduro de propidio y SYBR-
14. Se depositó 1μL de cada fluorocromo en 100 μL de cada tratamiento diluido
en solución salina (PBS), y se dejaron incubar en la oscuridad durante 5 minutos.
Posteriormente, se depositó 5 μL de cada muestra teñida sobre un porta y un
cubre objetos, para analizar las muestras con un microscopio de fluorescencias.
Se analizaron cinco campos y se contaron 100 células, tomando como
espermatozoides vivos los teñidos de color verde y los muertos aquellos que
presentaban color rojo.

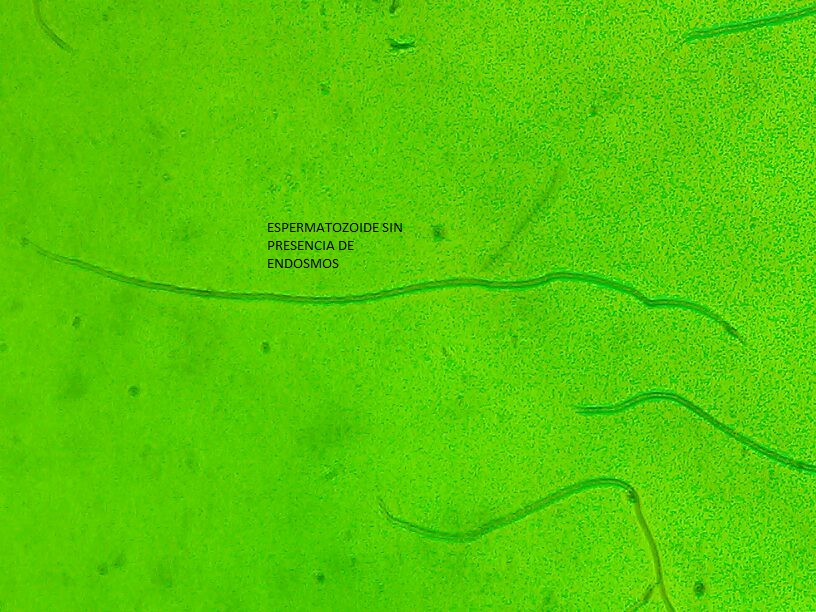
Endósmosis espermática. Se evaluó mediante la técnica descrita por Nur
(2012), utilizando 1.7 μL de semen en 250 μL de glutaraldehido al 2% y a
temperatura ambiente durante 5 minutos de incubación a 37ºC. Posteriormente,
se colocaron 5 µL de la muestra en una porta y cubre objetos, y se realizó el
conteo de 100 espermatozoides entre los que presentaban colas enrolladas (E+) y
no enrolladas (E-).
Criopreservación. Todas las muestras espermáticas de los tratamientos fueron
envasadas en pajuelas de 0.25 mL y almacenadas en un recipiente con agua a
temperatura ambiente (37ºC). Después, el recipiente con las pajuelas se introdujo
en un refrigerador durante 50 minutos, provocando de esta forma un descenso
gradual de la temperatura a 5 ˚C/min. Posteriormente, las pajuelas fueron
colocadas a una distancia de 4 cm de la superficie del nitrógeno líquido durante
20 minutos, para su congelación y almacenamiento en nitrógeno líquido hasta su
descongelación mediante inmersión en agua a 25ºC durante 60 segundos (Taylor
et al., 2009).

Conclusión. El Glicerol es el que mejor mantiene las características espermáticas
a la dilución sin importar el tipo de yema de huevo, mientras que a la congelación-
descongelación únicamente la YHE + DMSO actúan de forma negativa sobre los
espermatozoides.
Agradecimiento. Este trabajo fue financiado parcialmente por el Proyecto TecNM
14555.22-P.
** Documento parcial extraído del original “Efecto de la yema de huevo entera y
centrifugada sobre la criopreservación de espermatozoides de zángano (Apis
mellifera).” Revista BIO ciencias, con fines de difusión de las técnicas.
Referencias
Collins, A. M., and Donoghue, A. M. (1999). Viability assessment of honey bee,
Apis mellifera, sperm using dual fluorescent staining. Theriogenology, 51 (8),
1513-1523. DOI: 10.1016/S0093-691X(99)00094-1
Harbo, J. R. (1983). Survival of honey bee (Hymenoptera: Apidae) spermatozoa
after two years in liquid nitrogen (–196 C). Annals of the Entomological Society of
America, 76 (5), 890-891. DOI: 10.1093/aesa/76.5.890
Laidlaw, H. and Lorenzen, C. (1977). Laidlaw instrumental insemination instrument
[Queen honey bees]. American Bee Journal (USA). Disponible en:
http://agris.fao.org/agris-search/search.do?recordID=US7728540
Locke, S. J. and Peng, Y. S. (1993). The effects of drone age, semen storage and
contamination on semen quality in the honey bee (Apis mellifera). Physiological
entomology, 18, 144-148. DOI: 10.1111/j.1365-3032.1993.tb00461.x
Stucky, M., Hopkins, B. K., and Herr, C. (2008). 94 Cryopreservation of Honey
Bee Spermatozoa. Reproduction Fertility and Development, 20 (1), 127-128. DOI:
10.1071/RDv20n1Ab94
Nur, Z., Seven-Cakmak, S. Ustuner, B. Cakmak, I. Erturk, M. Abramson, C. I.
Sağirkaya, H. and Soylu, M. K. (2012). The use of the hypo-osmotic swelling test,
water test, and supravital staining in the evaluation of drone sperm. Apidologie, 43,
31-38. DOI: 10.1007/s13592-011-0073-1
Taylor, M. A., Guzman-Novoa, E. Morfin, N. and Buhr, M. M. (2009). Improving viability of cryopreserved honey bee (Apis mellifera L.) sperm with selected
diluents, cryoprotectants, and semen dilution ratios. Theriogenology, 72, 149-59.
DOI: 10.1016/j.theriogenology.2009.02.012
World Health Organization. (2010). WHO laboratory manual for the examination
and processing of human semen, 5th ed. Geneva: World Health
Organization. http://www.who.int/iris/handle/10665/44261




